Secondo John Wikswo, fondatore dello statunitense Vanderbilt Institute for Integrative Biosystems
Research and Education (VIIBRE) – la storia delle scienze della vita è caratterizzata da una
circolarità, che non esita a definire ermeneutica, tra riduzione e ricostruzione. La spinta ricostruttiva più recente è stata paradossalmente determinata proprio dal più grande trionfo dell’approccio riduzionista, il sequenziamento del Genoma Umano. La genomica comparata e funzionale, gli straordinari progressi della biologia computazionale, che hanno consentito la mappatura e l’annotazione funzionale di tutti i geni di una specie, il disvelamento della logica regolatoria che presiede all’espressione dei geni, hanno presto mostrato “quanto poco si sia concluso quando si sono risolti tutti i problemi”, per dirla con la celebre frase del primo Wittgenstein.
La sfida della Biologia dei Sistemi: rimettere insieme i pezzi
La spinta ricostruzionista ha trovato espressione nella Biologia dei Sistemi, dedita a “rimettere insieme i pezzi di Humpty Dumpy” (Denis Noble) così efficacemente dissezionati dall’analisi riduzionistica della biologia molecolare. Eppure, la concentrazione predominante sulla dimensione genomica della complessità biologica ha portato ad una nuova impasse. “Nonostante abbiamo risolto il Genoma Umano, ancora non capiamo come tessuti ed organi embrionali siano fisicamente costruiti in forme tridimensionali ottimizzate precisamente per svolgere le loro funzioni specializzate” (Donald Ingber). Se la Biologia dei Sistemi è efficacemente riuscita a mettere i geni nel contesto delle sofisticate architetture delle reti genomiche, comprendendone la funzione come esito delle complesse computazioni da esse svolte, la sfida oggi è mettere quelle stesse reti genomiche nel contesto della realtà tridimensionale dell’organismo, integrando verticalmente i vari livelli di complessità strutturale in cui si articola l’ambiente interno del corpo – la dimensione ecologica in cui si situano le interazioni tra cellule, tessuti, organi e sistemi di organi.
La “saggezza” della matrice extracellulare
Se infatti la ricerca su trapianti nucleari ha dimostrato senza residuo che lo stato differenziato delle cellule è reversibile se le si espone al giusto mix di fattori di trascrizione, evidenze crescenti hanno messo in luce che soprattutto la parte “solida” del microambiente, la matrice extracellulare secreta dalle cellule stesse, è in grado di modificare la determinazione cellulare, dirigendo ad esempio la differenziazione delle cellule staminali ma anche riportando cellule tumorali ad un comportamento normale. E, last but not least, che la strategia della comunicazione biunivoca tra cellule e microambiente non è solo biochimica, ma anche e soprattutto biomeccanica, a partire dalla capacità della matrice extracellulare di segregare fattori solubili come specifici fattori di crescita e modularne il rilascio con una tale precisione da evocare l’encomio di una “saggezza della matrice”.
Modellare i processi biologici in modo realistico
La sfida di modellare i processi biologici – tanto fisiologici quanto patologici – in modo realistico ricostruendo le caratteristiche biochimiche e biomeccaniche del microambiente per indurre la risposta cellulare desiderata non risponde solo alle esigenze della ricerca biomedica di base. Essa è
ancora più decisiva per la ricerca farmaceutica, che patisce da tempo per la scarsa predittività (stimata intorno a un misero 10%) dei test preclinici svolti su modelli in vitro bidimensionali, non alleviata dall’uso di modelli animali, il cui impiego risulta inoltre sempre più inaccettabile alla coscienza etica contemporanea.
Ma oggi è divenuto infine possibile raccogliere questa sfida? La crescente sinergia tra bioingegneria, con il decisivo apporto della scienza dei biomateriali sintetici, e biomedicina ha reso possibile la costruzione di sistemi sperimentali microfisiologici tridimensionali avanzati in vitro.
L’ingegneria dei tessuti ha raffinato tecniche in grado di guidare i processi autoorganizzativi delle cellule e ha reso possibile ottenere i cosiddetti “organoidi” multicellulari in vitro, capaci di ricapitolare le prime fasi dello sviluppo d’organo a partire da diversi tipi di cellule staminali. Tra i più celebri, gli organoidi cerebrali capaci di riprodurre la differenziazione regionale del cervello, e già impiegati sia per modellare patologie dello sviluppo cerebrale, come la microcefalia, che per testare sperimentalmente la capacità tumorigenica di determinati fenotipi cellulari, ed evidentemente una piattaforma formidabile per test farmacologici preclinici.
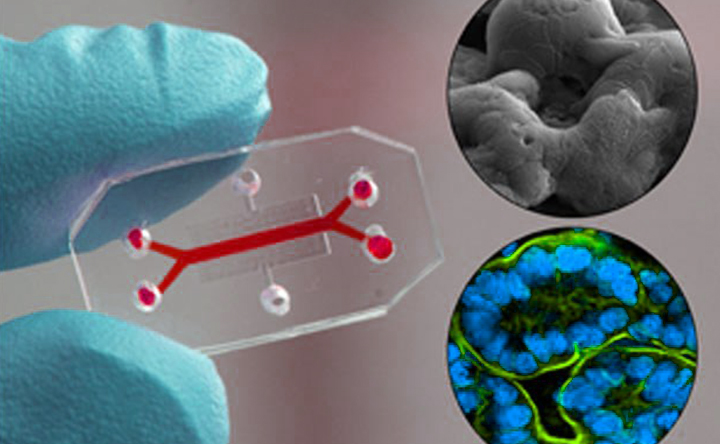
Organi on Chip: una rivoluzione nella modellazione dei sistemi biologici
Più rivolti a simulare specifiche funzioni fisiologiche di organo sono gli “organi su chip”, che riescono con l’ausilio di tecnologie microfluidiche tanto a scolpire precisamente il microambiente di tessuti ed organi che a controllarne dinamicamente molteplici parametri in parallelo. Modellando le interfacce costitutive delle funzioni fisiologiche dell’organo in un ambiente meccanicamente dinamico, si riescono ad ottenere polmoni microfisiologici che respirano, intestini peristaltici, fegati che filtrano, e ed è già più che una promessa la fabbricazione di interi sistemi di organi composti da chip interconnesse, in grado di testare l’intero percorso farmacocinetico di sostanze precisamente somministrate – i cosiddetti corpi su chip, affettuosamente ribattezzati omuncoli. Organoidi e organi su chip sono attualmente la frontiera dei sistemi sperimentali tridimensionali in vitro. Non solo questi modelli sono finalmente completamente “umani”, la loro promessa maggiore è la piena personalizzazione, per la relativa facilità di costruire modelli individualizzati di processi fisiologici e patologici di organo – dei veri e propri “sé” in miniatura. Questi nostri doppi, che in un domani ormai prossimo potrebbero abitare il nostro mondo come surrogati della nostra identità biologica – se non, nel caso degli organoidi, addirittura come parti di riserva per trapianti autologhi che ci consentiranno di smentire la trista distopia del celebre romanzo del Nobel Ishiguro – sono tanto una promessa che una nuova sfida, tanto bioetica quanto filosofica.
Quella bioetica è già una realtà: le banche di organoidi sono già in costruzione, e ripropongono tutte le complesse tensioni tra privacy e solidarietà, controllo e mercato che affliggono le biobanche attuali. Quella filosofica, non meno impegnativa, aggiunge un nuovo tassello al problema sempre più pressante di ripensare l’integrità e la storicità dell’individuo nell’era del “corpo rigenerativo”.
Understansding Complexity in Life Sciences
che si terrà in Bicocca il 14 ed il 15 febbraio 2019.Clicca qui per scaricare il programma ed iscriverti
Understansding Complexity in Life Sciences
Università di Milano Bicocca, 14 – 15 febbraio 2019.